Tin Tức Chuyên Ngành
H2SO4 là gì? Tính chất, ứng dụng & lưu ý khi sử dụng | Đình Hải Plastic
H2SO4 là gì? hay axit sunfuric là gì là thắc mắc được nhiều người quan tâm. Đây là hóa chất được sử dụng trong nhiều lĩnh vực khác nhau trong đời sống với tên gọi vô cùng quen thuộc. Trong phần nội dung hôm nay, Đình Hải Plastic sẽ cung cấp cho quý vị thông tin hữu ích xoay quanh chủ đề này nhé!
Axit sunfuric H2SO4
H2SO4 là gì?
H2SO4 là công thức hóa học của axit sunfuric. Đây là loại axit vô cơ gồm các nguyên tố hidro (H), oxi (O), lưu huỳnh (S). H2SO4 không màu, không mùi có độ nhớt, có khả năng hòa tan trong nước, đặc trưng với phản ứng tỏa nhiệt mạnh.
Axit sunfuric không bị bay hơi, nặng gần gấp đôi nước, chất này rất hiếm khi tồn tại ở dạng tinh khiết trong tự nhiên. Phổ biến thường gặp nhất là H2SO4 có trong các trận mưa axit (thường là SO2 hay H2SO4 bị oxi hóa trong nước). Loại hóa chất này được ứng dụng đa dạng trong đời sống, hàng năm có đến hơn 150 triệu tấn H2SO4 được dùng trong các lĩnh vực như sản xuất các chất nông học, chất dẻo, thủy tinh,…
Tính chất vật lý của H2SO4
Nếu tìm hiểu về axit sunfuric thì chắc chắn bạn không thể bỏ qua thông tin chi tiết về tính chất học của chất này:
- Là chất lỏng, tính nhớt, sánh như dầu
- Nặng gấp đôi nước
- Khó bay hơi
- Khả năng tan vô hạn trong nước
- Axit đặc hút nước mạnh, phản ứng tỏa nhiệt khi cho axit từ từ vào nước
- Có thể làm than hóa hợp chất hữu cơ

Tính chất vật lý H2SO4
Tính chất hóa học H2SO4
Axit H2SO4 là loại axit mạnh có những tính chất hóa học khác nhau dựa vào nồng độ của chúng
Với axit H2SO4 loãng
- Acid sunfuric loãng làm quỳ tím hóa đỏ – tính chất đặc trưng của axit
- Tác dụng với kim loại đứng trước H trừ (Pb) để tạo thành muối sunfat và giải phóng khí H2
Fe + H2SO4 → FeSO4 + H2
Mg + H2SO4 → MgSO4 + H2
- Tác dụng với oxi bazo cho ra muối (kim loại giữ nguyên hóa trị) và nước
FeO + H2SO4 → FeSO4 + H2O
MgO + H2SO4 → MgSO4 + H2O
- Tác dụng với bazơ hình thành muối và nước
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Cu(OH)2 + H2SO4 → CuSO4 + 2 H2O
- Tác dụng với muối để tạo thành muối mới (kim loại giữ nguyên hóa trị) và axit mới
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2 KHCO3 → K2SO4 + 2H2O + 2CO2
Với axit H2SO4 đặc
Axit sunfuric đặc có lưu huỳnh với số oxi hóa -2; 0, +4, +6, trong đó +6 là mức oxi hóa cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và háo nước.
- Tác dụng với kim loại:
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Lưu ý: H2SO4 đặc tác dụng được hầu hết các kim loại trừ Au, Pt. Axit sunfuric đặc nguội không phản ứng với Al, Fe, Cr. Sản phẩm khử của S+6 tùy thuộc vào độ mạnh yếu của kim loại, tính khử mạnh thì S+6 bị khử xuống mức oxi hóa càng thấp.
- Tác dụng với phi kim tạo ra oxit axit, nước và lưu huỳnh đioxit:
S + 2H2SO4 → 3SO2 + 2H2O
C + 2H2SO4 → CO2 + 2H2O + 2SO2
- Tác dụng với các chất khử tạo muối, nước và lưu huỳnh đioxit
2H2SO4 + 2 FeSO4 → Fe2(SO4)3 + SO2 + 2H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- Tính háo nước của axit sunfuric : Tác dụng khiến đường phân hủy
C12H22O11 + H2SO4 → 12C + H2SO4 .11H2O

Tính chất hóa học của acid Sunfuric
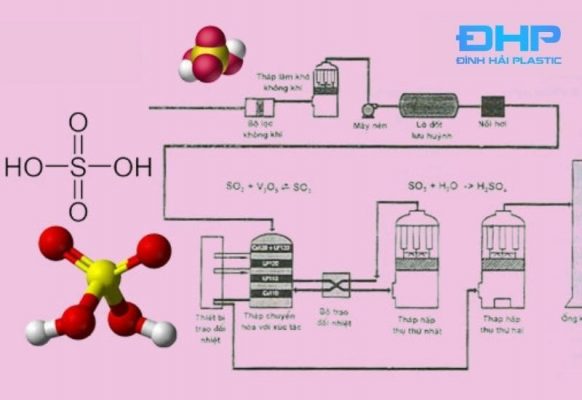
Điều chế Axit sunfuric
Acid H2SO4 được điều chế bằng cách đốt cháy quặng pirit sắt, oxi hóa SO2 thông qua oxi ở nhiệt độ cao từ 400 -500 độ C. Sau đó pha loãng chất oleum để tạo ra H2SO4 khi có lượng nước thích hợp (FeS2 hoặc S → SO2 → SO3 → H2SO4). Phương trình phản ứng lần lượt diễn ra như sau:
- 4FeS2 + 11O2 → 8SO2 + 2Fe2O3
- 2SO2 + O2 → 8SO3 ((nhiệt độ 400 -500 độ C, xúc tác V2O)
- nSO3 + H2SO4 → H2SO4 .nSO3
- H2SO4 .nSO3 + (n+1) H2O→ (n+1)H2SO4
Điều chế Axit sunfuric
Tính dẫn điện và tính phân cực của H2SO4
H2SO4 tinh khiết là chất lỏng phân cực có hệ số điện môi gần bằng 100 bởi các phân tử có thể proton hóa lẫn nhau khiến dẫn điện cực cực cao. Đây được gọi là quá trình chuyển hóa proton.
- Phương trình phản ứng phân cực:
2H2SO4 → H3SO4+ + HSO4-
- Một số phản ứng khác có thể sảy ra:
2H2SO4 → H3O+ + HS2O7-
H3O+ + H2SO4 → H3SO4 + + H2O
HS2O7- + H2SO4 ⇌ HSO4- + H2S2O7
Những điều lưu ý về axit sunfuric
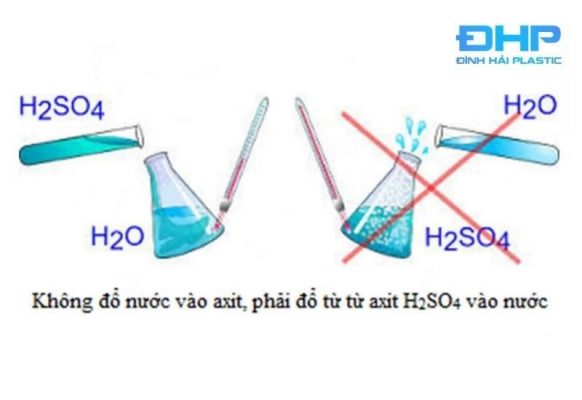
Chúng ta đều biết axit sunfuric H2SO4 là loại axit vô cơ mạnh, tính ăn mòn cao. Đặc biệt khi chúng ở nồng độ cao, đậm đặc sẽ dẫn đến bị bỏng nặng nến không may bị bắn vào người, rơi vào vải, giấy sẽ bốc cháy nên loại hóa chất này được đựng trong can nhựa 20l để tránh đảm bảo an toàn.
- Cần thật thận trọng khi sản xuất, sử dụng các loại axit này, nhất là H2SO4 lại có tính háo nước thì sẽ phản ứng rất nhất, tỏa nhiệt lượng đáng kể. Vì vậy, khi thực hiện thí nghiệm hoặc pha chế H2SO4, chỉ được phép đổ từ từ axit sunfuric vào nước mà không làm theo chiều ngược lại nhằm đảm bảo an toàn.
- Axit Sunfuric H2SO4 được đun nóng sẽ tạo ra khí độc hại SO2 và SO3 nên cần lưu tâm.
- Loại hóa chất này hấp thụ mạnh với ẩm, áp suất hơi nước trê H2SO4 là 0.003mmHg.
- Khi đun H2SO4 ở nhiệt độ 30-40 độ C, bắt đầu tạo ra khí SO3, đun sôi lên đến 290 độ C và liên tục giải phóng SO3 trong thành phần của nó. Hydrat còn lại chứa 98.3% H2SO4 và Sôi ở 338 độ C.
- Khi làm lạnh sẽ chuyển thành dạng rắn, tinh thể H2SO4 nóng chảy ở 10,49 độ C. Tuy nhiên, axit lỏng dễ có thể chậm đông không hoá rắn ở dưới 0 độ C.
Những điều lưu ý về axit sunfuric
Ứng dụng của acid sunfuric
Là axit mạnh nên H2SO4 có tính ứng dụng cao trong đời sống đặc biệt là các lĩnh vực sản xuất công nghiệp, dưới đây là các ứng dụng tiêu biểu của hóa chất này:
- Sản xuất phân bón: H2SO4 là nguyên liệu để sản xuất axit photphoric cho các loại phân photphat và tạo ra amoni photphat.
- Sản xuất công nghiệp: Đây là ứng dụng chủ yếu của axit H2SO4 nổi bật như sản xuất nhôm sunfat; muối sunfat; các chất tẩy rửa trước khi mạ; chế tạo thuốc nổ; sản xuất chất dẻo; thuốc nhuộm; các loại dược phẩm;…. Ngoài ra axit với nước được dùng làm chất điện giải trong các loại ắc quy, axit chì,…
- Xử lý nước thải: Có vai trò quan trọng trong việc lọc, xử lý các tạp chất trong nước thải, hạn chế mùi khó chịu đồng thời axit sunfuric cũng có công dụng cân bằng độ pH của nước, loại bỏ các ion kim loại như Mg2+; Ca2+,…
- Trong phòng thí nghiệm: H2SO4 đặc là hóa chất thường thấy trong phòng thí nghiệm, được sử dụng để điều chế các loại axit khác như HCl, HNO3,…. Ứng dụng để nhận biết các chất khác nhau,..

Ứng dụng của axit Sunfuric
Cách bảo quản Axit Sunfuric
Mặc dù mang đến nhiều lợi ích trong các ngành sản xuất của con người nhưng nó cũng vô cùng độc hại. Câu hỏi đặt ra là làm thế nào để bảo quản H2SO4 đúng cách, an toàn? Đình Hải Plastic sẽ hướng dẫn quý vị cụ thể như sau:
- Bảo quản hóa chất bằng các thùng phuy, thùng nhựa chuyên dụng. Đặc biệt có thể dùng ibc tank 1000l sử dụng nhựa nguyên sinh kháng hóa chất, chống ăn mòn, không làm biến tính. Đồng thời loại thùng cao cấp này vô cùng an toàn cho con người, không gây rò rỉ, nắp đậy kín.
- Đặt thùng hóa chất tại những nơi khô ráo, thoáng mát, tránh ánh sáng trực tiếp từ mặt trời hay gần các chất bazơ, chất khử, tốt nhất để trong kho đựng hóa chất chuyên dụng
- Ghi rõ tem mác cho hóa chất, tránh để gần các kim loại, các loại axit khác nhau vì có thể dẫn đến cháy nổ. Đảm bảo khi tiếp xúc với hóa chất con người đã trang bị đày đủ đồ bảo hộ nhằm đảm bảo an toàn.

Cách bảo quản Axit Sunfuric bằng tank ibc 1000l
Trên đây là giải đáp chi tiết H2SO4 là gì?, đặc điểm về tính chất lý hóa. Hóa chất này có tính ứng dụng cao trong đời sống tuy nhiên vô cùng nguy hiểm, bạn cần bảo quản chúng vào thùng ibc tank 1000l để đảm bảo an toàn, phòng ngừa cháy nổ và nguy hiểm nhé!
